Год назад, подводя итоги 2020 года, ведущие мировые эксперты сходились на мнении, что объем мирового рынка медицинских изделий снизится примерно на 3% по сравнению с 2019 годом. Однако, анализ итоговых данных за 2020 год показал, что совокупный объем мирового рынка медицинских изделий в 2020 году достиг 456,9 млрд долларов, что на 7,5% выше показателя 2019 года.
Стремительный рост мирового рынка объясняется продолжающейся пандемией COVID-19, увеличением количества медицинских учреждений и расходов на здравоохранение, а также старением населения и ростом стоимости медизделий, в результате внедрения достижений технического прогресса и инновационных решений.
Сохранение высоких показателей заболеваемости коронавирусом по всему миру в 2021 году способствует продолжению роста мирового рынка медицинских изделий. Мировые эксперты не исключают увеличение его объемов до 612,7 млрд долларов к 2025 году. Топ-10 международных компаний производителей медицинских изделий в 2021 году (по версии Proclinical) представлено на рисунке ниже.
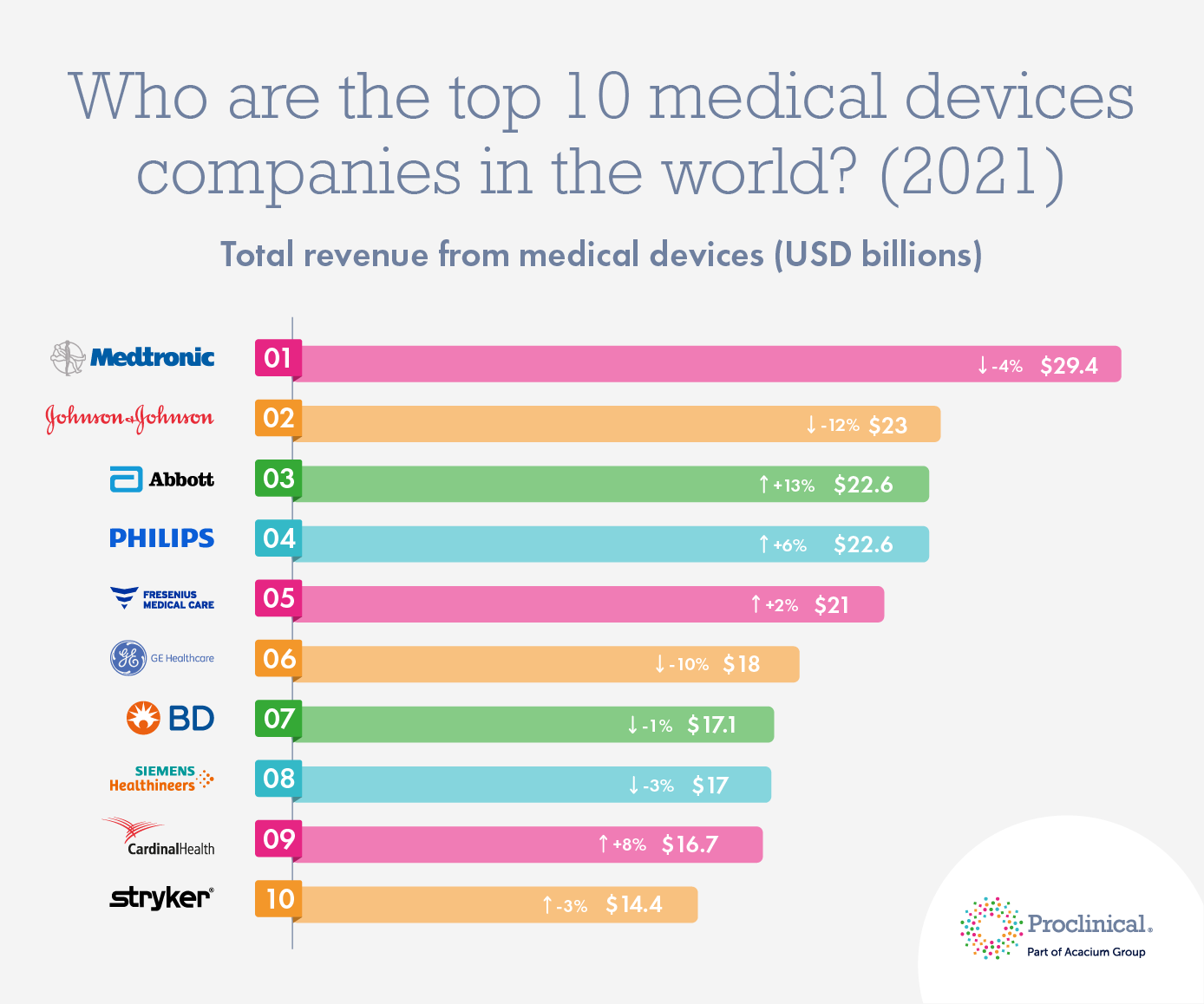
Источник: https://www.proclinical.com/blogs/2021-8/who-are-the-top-10-medical-device-companies-in-2021
Объем российского рынка медизделий в 2020 году скачкообразно вырос до уровня 740,9 млрд. руб., что составляет около 2,25% от мирового рынка медизделий.
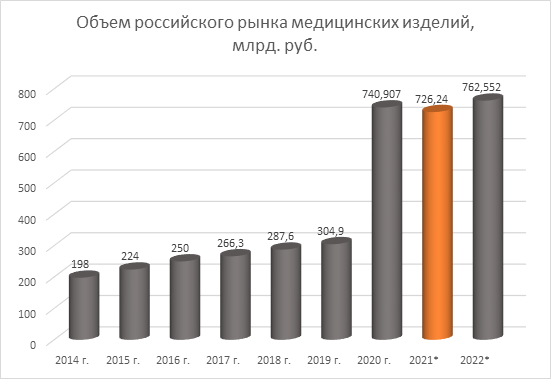
Как видно из диаграммы выше, несмотря на падение объемов отдельных сегментов рынка медизделий в 2020 году, общий его объем вырос почти на 150%. Рост вызван увеличением поставок медизделий для реанимации, лабораторной (in-vitro) диагностики и общебольничного оборудования, в связи с пандемией коронавирусной инфекции.
Согласно предварительным данным аналитиков, в 2021 году объем российского рынка медизделий сократился на 2%, на фоне частичного насыщения потребностей системы здравоохранения. Однако, в 2022 году прогнозируется рост рынка на 5%, в связи с продолжающимся ростом стоимости современных медицинских изделий и увеличением объемов диагностики.
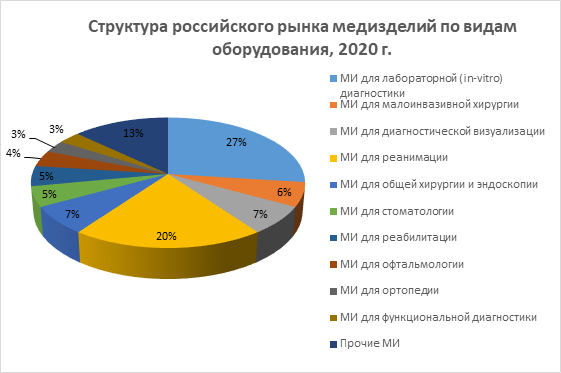
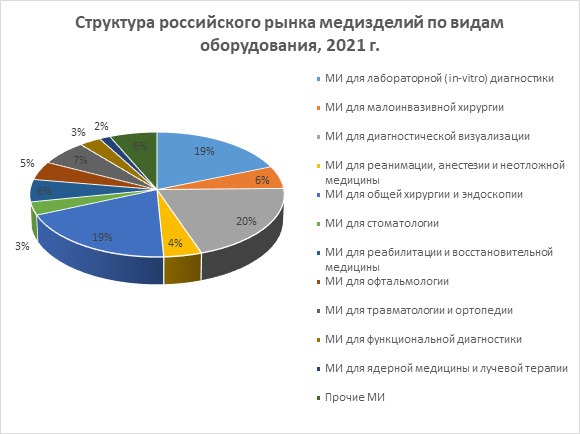
В 2021 году существенно вырос сегмент медизделий для диагностической визуализации, а также изделий для хирургии и эндоскопии.
Кроме того, в 2021 году продолжила снижаться доля импорта медицинского оборудования. В 2020 году объем импорта сократился на 6,5%, а в 2021 году еще на 1,5%.

В 2021 году официально завершился переход к общему рынку медицинских изделий в рамках ЕАЭС, предполагающий существенное изменение процедур регистрации и регулирования обращения медицинских изделий.
Для подготовки данного перехода было принято большое число нормативно-правовых актов с высокой степенью регулирующего воздействия:
1. Согласованный проект распоряжения Совета Евразийской экономической комиссии «О внесении изменения в Соглашение о единых принципах и правилах обращения медицинских изделий (изделий медицинского назначения и медицинской техники) в рамках Евразийского экономического союза от 23 декабря 2014 года» был опубликован еще марте 2021 года. Однако, его ратификация всеми сторонами ЕАЭС состоялась только 30 декабря 2021 года.
Согласно данному распоряжению, регистрация медизделий, заявление по которым было подано до 31 декабря 2021 года, будет осуществляться в порядке, предусмотренном законодательством государства-члена.
Переходный период для перерегистрации медицинских изделий в порядке, предусмотренном законодательством государства-члена, продлевается до 31 декабря 2026 года.
В период с 01.01.2022 г. до 31.12.2026 г. предлагается сохранить возможность внесения изменений в регистрационные документы уже зарегистрированных и обращаемых на территории РФ медицинских изделий.
Медицинские изделия, зарегистрированные по национальным нормам одного из государств ЕАЭС, могут выпускаться в обращение на территории этого государства до окончания срока действия национальных регистрационных удостоверений.
2. В апреле 2021 года вступил в силу договор о товарных знаках, знаках обслуживания и наименовании мест происхождения товаров Евразийского экономического союза от 3 февраля 2020 года. Договор дает возможность подавать одну заявку на товарный знак ЕАЭС или на наименование места происхождения товара ЕАЭС в любое из патентных ведомств государств Союза с последующим получением правовой охраны одновременно на территории всех стран ЕАЭС.
3. В соответствии с Федеральным законом от 30.04.2021 № 128-ФЗ "О внесении изменений в Федеральный закон "Об основах охраны здоровья граждан в Российской Федерации" были определены условия использования медицинских изделий по истечении срока их регистрации. Согласно внесенным изменениям, владельцы медизделий могут использовать их после окончания действия регистрационного удостоверения, если их срок службы не истек. Кроме того, до конца срока службы (срока годности) можно применять медизделия, произведенные в течение 180 календарных дней после изменения регистрационного досье. Причем руководствоваться можно документацией, которую использовали ранее.
Кроме того, документом расширен перечень не подлежащих регистрации медизделий. В него входят:
4. В июле 2021 года были опубликованы Рекомендации Коллегии ЕЭК № 15 "О внесении изменений в Критерии отнесения продукции к медицинским изделиям в рамках Евразийского экономического союза". Рекомендации были подготовлены с учетом правоприменительной практики и уточняют отдельные примеры, в том числе программного обеспечения, используемого в медицинском изделии.
5. Осенью 2021 года начал работу Консультативный комитет по медицинским изделиям ЕАЭС. Его работа должна стать эффективным инструментом решения сложных вопросов, связанных с процедурами регистрации, в том числе с классификацией продукции в качестве медицинских изделий.
6. В ноябре 2021 года Госдума РФ продлила действие льгот по НДС на медизделия, зарегистрированные по российским правилам. В предыдущей редакции Налогового кодекса РФ возможность получения нулевой ставки и льгот по налогу на добавленную стоимость (НДС) распространялась на медизделия, имеющие регудостоверение ЕАЭС, либо изделия, валидированные по российским правилам, но до 31 декабря 2021 года. В новой редакции исключается фраза «до 31 декабря 2021 года», и действие нормы в отношении российских регистрационных удостоверений не ограничиваются по времени.
7. Кроме того, Госдума РФ в первом чтении одобрила поправки в Налоговый кодекс, предполагающие рост госпошлин на процедуры регистрации медизделий, БМКП и лекарств. Как следует из документа, в новой редакции Налогового кодекса госпошлина за выдачу регудостоверения на медицинское изделие увеличится с 7 тысяч до 11 тысяч рублей, за проведение экспертизы качества, эффективности и безопасности класса 1 – с 45 тысяч до 72 тысяч рублей, класса 2а – с 65 тысяч до 104 тысяч рублей, класса 2б – с 85 до 136 тысяч рублей, класса 3 – со 115 до 184 тысяч рублей. Сбор за внесение изменений в досье вырастет с 1,5 тысяч рублей до 2,5 тысяч, а расценки на повторную экспертизу вырастут с 20–50 тысяч рублей, в зависимости от класса риска, до 32–104 тысяч рублей.
Размер госпошлины за предоставление разрешения на применение незарегистрированного медизделия для диагностики in vitro составит 9,5 тысячи рублей, за проведение экспертизы качества, безопасности и эффективности подобных медицинских изделий – 65,8 тысячи рублей. Пошлина за проведение экспертизы качества биомедицинских клеточных продуктов (БМКП) при регистрации составит 580 тысяч рублей, экспертизы эффективности и отношения ожидаемой пользы к возможному риску применения БМКП – 220 тысяч рублей.
Повышение госпошлин вызвано «увеличением издержек по осуществлению данных юридически значимых действий».
8. В декабре было подписано Постановление Правительства РФ о продлении упрощённого порядка регистрации медицинских изделий для борьбы с коронавирусом до 1 января 2025 года. Также до 1 января 2025 года продлевается действие уже выданных временных регистрационных удостоверений и разрешений на использование медицинских изделий.
Еще в августе 2021 г., выступая на Всероссийском форуме InnoMed в Пензе, замруководителя Росздравнадзора Дмитрий Павлюков рассказал, что число зарегистрированных в России медизделий за время пандемии увеличилось более чем в полтора раза. С 1 469 медицинских изделий в 2019 году, до 3 630 изделий в 2020 году, в том числе 1 969 - российских медизделий и 1 661 – зарубежное.
Завершая обзор изменений нормативной документации в сфере регистрации медицинских изделий, необходимо отметить, что 24 декабря на заседании Совета Евразийской экономической комиссии был рассмотрен вопрос о внесении новых изменений в Соглашение о единых принципах и правилах обращения медицинских изделий, согласно которым режим национальной регистрации медизделий может быть продлен на один год (до 31 декабря 2022 года).
Одобренным Протоколом Совета предусмотрена просьба к государствам – членам Евразийского экономического союза до 20 января 2022 г. завершить внутригосударственные процедуры, необходимые для подписания обновлённой версии Протокола.
Согласно пояснениям, размещенным на официальном сайте Росздравнадзора 11 января 2022 года, подача заявлений на получение регистрационных удостоверений на медицинские изделия по национальной процедуре прекращена с 1 января 2022 года. Информацию о возможности и сроках возобновления подачи документов, в случае продления режима национальной регистрации, Росздравнадзор разместит позднее.
 Еще одной важной темой развития российского рынка медицинских изделий стало введение обязательного соответствия производства медизделий системе менеджмента качества (СМК), в соответствии с поправками в 323-ФЗ «Об основах охраны здоровья граждан в РФ». Необходимость внедрения СМК также предусмотрена процедурой получения регистрационного удостоверения по правилам ЕАЭС.
Еще одной важной темой развития российского рынка медицинских изделий стало введение обязательного соответствия производства медизделий системе менеджмента качества (СМК), в соответствии с поправками в 323-ФЗ «Об основах охраны здоровья граждан в РФ». Необходимость внедрения СМК также предусмотрена процедурой получения регистрационного удостоверения по правилам ЕАЭС.
1. В 323-ФЗ закреплен обязательный мониторинг всех зарегистрированных медизделий на предмет выявления и предотвращения всех неблагоприятных событий, связанных с применением и эксплуатацией медицинских изделий, а не только побочных эффектов, угрожающих жизни и здоровью граждан.
Для мониторинга будут использоваться в том числе и сведения, предоставленные производителем или уполномоченным лицом, ввозящим медицинские изделия из-за границы.
2. В конце июля 2021 года Минздрав РФ представил проект требований к внедрению, поддержанию и оценке системы управления качеством медицинских изделий в зависимости от потенциального риска их применения.
Как следует из проекта документа, производители медизделий 1 класса и нестерильных медизделий 2а класса будут внедрять СМК в добровольном порядке. Для производителей медицинских изделий класса потенциального риска 2а (для медицинских изделий, выпускаемых в стерильном виде) и 2б внедрение системы управления качеством стало обязатльным (за исключением процессов проектирования и разработки).
Производители медизделий класса потенциального риска применения 3, должны внедрить СМК, включающую процессы проектирования и разработки.
Для внедрения системы менеджмента качества производитель обязан разработать требования к управлению рисками на всех этапах жизненного цикла медицинских изделий, а также параметры их внедрения в практику и реализацию на предприятии, включая последовательность и взаимосвязь этих процессов. Кроме того, производитель будет обязан определить критерии и методы оценки результативности СМК, проводить мониторинг, измерение и анализ процессов, а также принимать меры, необходимые для достижения запланированных результатов.
3. Кроме того, Минздрав РФ разработал проект правил инспектирования производства медицинских изделий на предмет соответствия системы менеджмента качества в зависимости от потенциального риска применения выпускаемой продукции. Проводить контроль, будет уполномоченный Росздравнадзором орган, а результаты будут вноситься в виде специального отчета об инспекции в реестр производителей медизделий и регистрационные удостоверения.
Инспекция коснется предприятий, производящих медизделия, которые подлежат госрегистрации в случаях, требующих проведения экспертизы качества, эффективности и безопасности, а также имплантируемых медицинских изделий, изготовленных по индивидуальным заказам.
Инспектирование производства будет проводиться в течение 90 дней с момента подачи заявки предприятием, интервал плановой проверки будет составлять 5 лет. Внеплановые проверки будут проводиться из-за внесения изменений в перечень производственных площадок, на которых выпускаются медизделия и которые не прошли контроль, либо в связи с устранением нарушений, выявленных в ходе контроля или мониторинга безопасности обращения медизделий.
4. Согласно Решению Совета Евразийской экономической комиссии от 12 ноября 2021 г. N 131 "О внесении изменений в Требования к внедрению, поддержанию и оценке системы менеджмента качества медицинских изделий в зависимости от потенциального риска их применения" допускается проведение оценки системы менеджмента качества медицинских изделий с использованием средств дистанционного взаимодействия (например, посредством видеосвязи).
 В 2021 году в сфере государственных закупок было принято несколько нормативно-правовых актов с высокой степенью регулирующего воздействия:
В 2021 году в сфере государственных закупок было принято несколько нормативно-правовых актов с высокой степенью регулирующего воздействия:
1. В марте 2021 года перечень товаров по правилу «третий лишний», был расширен Постановлением Правительства Российской Федерации от 06.03.2021 № 336 еще на шесть видов медизделий. В обновленный список вошли биохимические анализаторы, фетальные мониторы, микроскопы – медицинские, биологические и для лабораторной диагностики, ультразвуковые хирургические аппараты и хирургические коагуляторы, а также лазерные терапевтические аппараты.
2. Еще одним важным изменением в системе государственных закупок стал запрет на объединение разных наименований медизделий в один лот или контракт (Постановление Правительства Российской Федерации от 19.04.2021 № 620). Согласно данному постановлению, медицинские изделия не могут быть предметом одного контракта (лота), при условии, что значение начальной (максимальной) цены контракта (цены лота) превышает:
Исключение составят закупки по контрактам жизненного цикла (КЖЦ), а также приобретение медоборудования с расходными материалами, предусмотренными производителем.
3. В мае 2021 года были внесены изменения в Постановление Правительства Российской Федерации от 3 декабря 2020 г. № 2013, согласно которым, к товарам российского происхождения приравниваются товары из государств Евразийского экономического союза, включенные в специальный реестр, который ведется в соответствии с Постановлением Правительства РФ от 30 апреля 2020 г. № 616.
А затем был принят план взаимного признания электронной цифровой подписи странами ЕАЭС при госзакупках.
4. В начале сентября 2021 года, Правительство РФ вывело 30 видов медицинского оборудования из-под действия постановления Правительства РФ №102 от 5 февраля 2015 года, известного как «третий лишний», и включило в реестр радиоэлектронной продукции, закупки которой более жестко регламентируются постановлением Правительства РФ №878 от 10 июля 2019 года «О мерах стимулирования производства радиоэлектронной продукции».
Согласно поправкам, при госзакупках включенных в перечень изделий, в случае если на конкурс будет выходить хотя бы один поставщик со страной происхождения медизделий из ЕАЭС, все остальные заявки с предложениями импортного медоборудования будут отклоняться.
Правило «второй лишний» введено в отношении компьютерных томографов, рентгеновских аппаратов, эндоскопических комплексов, ОФЭКТ и гамма-камер. Под него также попадут гамма-терапевтические аппараты, электрокардиографы, пульсоксиметры и спирометры, оториноскопы, электроэнцефалографы, тонометры внутриглазного давления, аппараты УЗИ, микроволновой и ультразвуковой терапии. Кроме того, ограничения распространятся на магнитно-резонансные томографы, неонатальные облучатели, литотриптеры, дефибрилляторы, медицинские холодильники и морозильники, облучатели-рециркуляторы воздуха, стерилизаторы, электрохирургические аппараты, дыхательное оборудование, инкубаторы для новорожденных и консоли подвода медицинских газов.
5. В декабре был опубликован проект новых правил определения страны происхождения промышленной продукции, включая медизделия. Согласно которому, планируется ввести единый порядок получения заключения Минпромторга и акта экспертизы или сертификата СТ-1 Торгово-промышленной палаты РФ (ТПП РФ) о соответствии требованиям к локализации в электронном виде через государственную информационную систему промышленности (ГИСП).
Заключение Минпромторга РФ об отечественном происхождении продукции будет действовать в течение трех лет, однако производитель должен будет ежегодно, не позднее девяти месяцев с даты выдачи или с даты продления заключения, подавать в личный кабинет ГИСП акт ТПП РФ о проведении ежегодной оценки и подтверждении балльной оценки уровня локализации продукции. В случае несоответствия Минпромторг РФ будет вправе исключить из ГИСП производителя за несоответствие требованиям к локализации. Предполагается, что в случае утверждения документ вступит в силу с 1 февраля 2022 года.
6. Также в конце года были внесены изменения в постановление Правительства РФ №878 от 10 июля 2019 года «О мерах стимулирования производства радиоэлектронной продукции на территории Российской Федерации». Согласно принятым поправкам, до 31 декабря 2022 года для получения преимущества при госзакупках производителю достаточно будет подтвердить страну происхождения своих изделий с помощью сертификата по форме СТ-1. В документе указаны 44 наименования медицинской техники, на которые распространяется это правило.
Кроме того, из текста постановления исключены пункты, допускавшие возможность закупки иностранной продукции, если отечественные изделия по своим функциональным, техническим или эксплуатационным характеристикам не отвечали требованиям к планируемой закупке, которые установил заказчик. По новым правилам, если в торгах участвует хотя бы один производитель медицинских изделий из ЕАЭС, которые удовлетворяют требованиям извещения о закупке, иностранным поставщикам придется отказаться от участия.
При этом в случае, если на конкурс не выйдет ни один из отечественных производителей, клиника сможет закупить импортное медицинское оборудование без получения специального разрешения от Минпромторга РФ.
Также необходимо отметить, что в 2021 году руководством Минпромторга РФ была озвучена возможность введения санкций за нарушения квот на закупку отечественных товаров, в том числе медицинских изделий. Об этом сообщил журналистам замглавы Минпромторга РФ Василий Шпак в ходе рабочей поездки во Владимирскую область в среду.
"Работа ведется в нормативном плане, в законодательном. <…> Где-то приходится более суровые административные меры принимать. Пока за невыполнение квот никаких санкций нет в отношении руководителей предприятий, но мы вполне можем вернуться к рассмотрению этого вопроса, со временем, подведя итоги этого года, поняв статистику и проанализировав по отраслям, что у нас происходит", - сказал Василий Шпак.
С другой стороны, Постановлением Правительства Российской Федерации от 21.12.2021 № 2376 "О внесении изменений в постановление Правительства Российской Федерации от 3 декабря 2020 г. № 2014" был сокращен перечень медизделий, подпадающих под минимальные квоты на приобретение отечественной продукции на рынке госзаказа.
Из перечня медицинских изделий, подпадающих под минимальные квоты на приобретение отечественной продукции на рынке госзаказа, был исключен пункт операционных и смотровых медицинских светильников под кодом ОКПД 2 27.40.39.110, а также аппараты нижних конечностей под кодом 32.50.22.122. Под кодом 32.50.22.121 в перечень внесены внешние протезы с минимальной долей закупок в 45% в 2021 году, 47% в 2022 году и 50% в 2023 году.
 Рассмотрим подробнее развитие государственных программ в сфере медицинской промышленности в 2021 году:
Рассмотрим подробнее развитие государственных программ в сфере медицинской промышленности в 2021 году:
1. В 2021 году в Москве более чем на 80% была завершена масштабная программа закупок медицинской техники по контрактам жизненного цикла. По словам Анастасии Раковой, заместителя Мэра Москвы по вопросам социального развития, к началу августа 2021 года было закуплено уже 2955 единиц оборудования из 3640 запланированных. Некоторые виды техники закуплены полностью: 59 магнитно-резонансных томографа, 41 ангиограф, 30 маммографов, 1674 аппарата УЗИ, 723 единицы эндоскопического оборудования различных типов.
2. По итогам 1 квартала 2021 года, Счетная палата назвала Госпрограмму развития медпромышленности худшей по исполнению расходов. Расходы федерального бюджета на здравоохранение за 1 квартал 2021 года были исполнены только на 19,4%. Аудиторы также отметили несоответствия в государственной программе «Развитие здравоохранения» и Стратегии развития здравоохранения до 2025 года. По их мнению, в госпрограмме отсутствуют цели, задачи и показатели, содержащиеся в стратегическом документе.
3. В июле со 121 до 212 позиций был расширен перечень медоборудования для оснащения и переоснащения медицинских организаций при реализации региональных программ модернизации первичного звена здравоохранения. В него были внесены системы подъема и перемещения пациентов, оборудование для УВЧ-, УФ-, ультразвуковой терапии и электростимуляции, тренажеры, костыли и ортезы, медицинская мебель, а также ряд медизделий для комплектации фельдшерско-акушерских пунктов, включая дефибриллятор, тонометр, фонендоскоп, пульсоксиметр, термометр, секундомер, весы, ростомер и сантиметровую рулетку.
Кроме того, в список было включено лабораторное оборудование – экспресс-анализаторы уровня сахара, гемоглобина и холестерина, укладки для оказания экстренной и специализированной помощи и аптечки, а также гинекологическое кресло и профильные инструменты.
Помимо этого, ведомство уточнило ранее утвержденный перечень медицинских изделий, детализировав виды изделий в отношении рентгеновского оборудования, аппаратов ИВЛ, УЗИ, томографов и другого оборудования.
4. А в сентябре вице-премьер России Татьяна Голикова сообщила, что при необходимости региональные программы модернизации первичного звена здравоохранения могут быть продлены после 2025 года.
Подводя итоги 2021 года на заседании Совета при президенте по стратегическому развитию и национальным проектам 15 декабря Татьяна Голикова сообщила, что из запланированных в федеральном бюджете до 2024 года 500 млрд рублей на программу модернизации первичного звена здравоохранения выделено только 360 млрд.
Это обусловлено тем, продолжила Голикова, что старт модернизации «первички» был сдвинут с середины 2020 года на январь 2021-го. «Понятно, что с учетом сложностей и с учетом пандемии Министерство финансов несколько уменьшило те объемы. Но сейчас мы уже видим, что если мы не рассмотрим вопрос о сдвижке влево недостающих объемов, а они за границей 2024 года Минфином предусматриваются, то мы не сможем очень быстро провести те инфраструктурные изменения, которые планировали», – отметила вице-премьер.
5. В ноябре 2021 года Минпромторг РФ подготовил проект поправок в правила предоставления субсидий на разработку и производство конкурентноспособных медизделий. Перечень стратегических направлений, по которым будут выделяться субсидии на производство медизделий, будет формироваться Минздравом РФ по видам медицинских изделий в соответствии с номенклатурной классификацией и возможностью их серийного производства, после направляться в Минпромторг РФ и межведомственную комиссию для дальнейшей проработки и утверждения. Сам объем субсидии будет сокращен с первоначальных 70% до 50% от затрат организаций-производителей, направленных на реализацию проекта.
6. В декабре был расширен перечень современных технологий для заключения специальных инвестиционных контрактов (СПИК). В перечень технологий включено производство высокопольных МРТ 1,5 Тл для углубления локализации комплектующих изделий с последующим созданием отечественного серийного производства МРТ с характеристиками, «превышающими мировые образцы».
Кроме того, в список включен проект по выпуску полимерных офтальмологических имплантов – интраокулярных линз для хирургии катаракты и искусственной радужки глаза – с крайним сроком подписания СПИК до 1 декабря 2071 года, а также технологий производства гипоаллергенных пластырей с полиакрилатным адгезивом, чувствительным к давлению, и раневых повязок с пластифицированным парафином или пчелиным воском (с датой заключения не позднее 31 декабря 2030 года).
Согласно утвержденной Правительством РФ Программе госгарантий на 2022 год, на работу федеральных центров в ОМС запланировано 154,4 млрд рублей. Это заметно больше, чем в 2021-м, поскольку запланированных тогда 119,2 млрд рублей оказалось недостаточно. Кроме того, планируется зарезервировать 30 млрд рублей в бюджете Федерального фонда ОМС на случай «незапланированного роста» объемов оказываемой медпомощи «в условиях чрезвычайной ситуации».
Финансирование ВМП-II в федеральных клиниках запланировано в 2022 году на уровне 109,9 млрд рублей, что лишь на 2,7 млрд рублей больше субсидии прошлого года.
Кроме того, сформирован перечень «уникальных» методов лечения, уже успевший получить расхожее название «ВМП-III» по аналогии с перечнями высокотехнологичной медпомощи, включенной (ВМП-I) и не включенной (ВМП-II) в базовую программу ОМС. Как следует из документа, ВМП-III «вправе оказывать» только федеральные медорганизации. В актуальный перечень вошли восемь методов, применяемых в сердечно-сосудистой-хирургии и при трансплантации органов.
 В заключении, хотелось бы отметить еще несколько значимых изменений в области госконтроля за обращением медицинских изделий:
В заключении, хотелось бы отметить еще несколько значимых изменений в области госконтроля за обращением медицинских изделий:
1. Докладывая об итогах 2020 года, Росздравнадзор сообщил, что было проведено 1 183 проверок, в результате которых выявлено 223 недоброкачественных и 168 незарегистрированных медизделий. Почти 300 наименований медизделий было отозвано производителем, еще 51 – изъято из обращения регулятором.
В апреле 2020 году был наложен мораторий на плановые проверки. В результате объем выявленных нарушений снизился в четыре раза, а штрафов – в 13 раз.
2. В январе 2021 года Коллегией ЕЭК была утверждена Рекомендация «О принципах и подходах в отношении применения риск-ориентированного подхода в сфере государственного контроля (надзора) за соблюдением требований технических регламентов Евразийского экономического союза».
Модель риск-ориентированного подхода предусматривает осуществление государственного контроля (надзора) на основе оценки риска нарушения требований технических регламентов Союза. По результатам такой оценки выбираются форма, продолжительность и периодичность проведения мероприятий по государственному контролю (надзору).
3. В июне были приняты поправки в 323-ФЗ, касающиеся полномочий Росздравнадзора по изъятию фальсифицированной продукции. В закон была внесена обязанность владельцев фальсифицированных, недоброкачественных или контрафактных медизделий оплачивать расходы на изъятие из обращения некондиционной продукции, а не только на ее уничтожение.
Недоброкачественные и фальсифицированные медицинские изделия можно будет изъять из обращения и уничтожить на основании решения их владельца, Росздравнадзора или решения суда. Контрафактные медизделия будут подлежать изъятию и уничтожению только по решению суда.
4. Постановлением Правительства РФ № 1066 от 30.06.2021 определены изменения правил осуществления государственного контроля, утвержденных Федеральным законом № 248-ФЗ от 31.07.2020 «О государственном контроле (надзоре) и муниципальном контроле в Российской Федерации». В новом регламенте изменились формы проведения плановых проверок и их периодичность. Плановые проверки будут проводится в организациях, деятельность которых отнесена к группам со значительным, средним и умеренным риском. Для организаций значительного риска плановые проверки будут проводиться раз в 4 года, для среднего и умеренного — раз в 6 лет.
Помимо проверок, Росздравнадзор сможет применять инспекционные визиты, контрольные закупки и выборочный контроль качества медицинской продукции. Кроме того, в регламент введены пять видов предупреждающих мер по профилактике правонарушений в сфере обращения медицинских изделий: информирование, обобщение правоприменительной практики, объявление предостережения, консультирование и профилактический визит.
5. В октябре 2021 года Росздравнадзор проранжировал организации, занимающиеся обращением медицинских изделий, по категориям риска для проведения плановых проверок. В перечень субъектов, подпадающих под плановый контроль Росздравнадзора за обращением медицинских изделий, попало 6439 организаций, включая больницы, склады и заводы по их производству.
Перераспределение организаций ведомство проводило на основании критериев, утвержденных Постановлением Правительства РФ от 30.06.2021 № 1066 «О федеральном государственном контроле (надзоре) за обращением медицинских изделий». Для организаций категории умеренного риска, как и для категории среднего риска, период между плановыми проверками составит шесть лет. Организации со значительным риском будут проверяться чаще — каждые четыре года. Организации, не вошедшие в списки, были оценены как низкорисковые. У них плановый контроль не проводится.
6. В ноябре Минздрав РФ подготовил проект поправок в Положение о федеральном государственном контроле за обращением медицинских изделий, утвержденное постановлением Правительства РФ №1066 от 30 июня 2021 года. Согласно которому, смертность пациентов от неблагоприятных событий, при применении медицинских изделий войдет в перечень показателей госконтроля. Значение будет рассчитываться на основании сообщений, которые были направлены в течение отчетного года в Росздравнадзор субъектами обращения медицинских изделий. Целевой показатель предполагается утвердить на уровне не более 0,7 на 1 млн человек в 2022 году, 0,65 в 2023 году, 0,6 в 2024 году и 0,55 в 2025 году.
7. В конце 2021 года постановлением Правительства РФ №2129 от 30 ноября 2021 года был утвержден порядок лицензирования технического обслуживания медицинских изделий. В новой версии регламента прописан перечень оборудования, необходимого для сервиса медтехники по каждому из видов такой техники. Компании, занимающиеся техническим обслуживанием медоборудования, должны будут с 1 марта 2022 года до 1 января 2024 года подать заявление в Росздравнадзор о внесении изменений в реестр в связи с актуализацией перечня выполняемых работ по техобслуживанию.
Завершая обзор нормативной документации в сфере государственного контроля за обращением медицинских изделий, хотелось бы отметить, что в конце августа 2021 года, выступая IX Международном форуме "Антиконтрафакт-2021", министр здравоохранения РФ Михаил Мурашко рассказал, что обязательная маркировка лекарственных препаратов в настоящее время работает в штатном режиме и следующим шагом должно стать введение обязательной маркировки медицинских изделий.
Министр добавил, что должна быть создана информационная система, позволяющая идентифицировать каждую единицу медизделия. "В особенности высокотехнологичных и тех, которые имеют наибольшие риски", - сказал он.
В январе 2021 года в распоряжение Правительства РФ №792-р от 28 апреля 2018 года были внесены поправки, согласно которым с 1 февраля 2023 года вводится обязательная маркировка кресел-колясок, относящихся к медицинским изделиям, с ручным приводом и без механических устройств и электрические кресла-коляски с двигателем или иными механическими устройствами для передвижения под кодом ОКПД2 30.92.20 и кодами ТН ВЭД ЕАЭС 8713 10 000 0 и 8713 90 000 0.